RNA藥物是生物醫學研究領域新星,國立成功大學生物醫學工程學系楊閎蔚教授研究團隊與跨校、跨領域團隊,利用生物工程技術開發出以噬菌體為載體,運輸「干擾 RNA」到達目標腫瘤,以降低或抑制腫瘤特定基因表現之 RNA 奈米藥物。經動物實驗,可有效阻斷惡性腦癌(膠質母細胞瘤)基因自我修復,增強放射線治療成效。研究成果已發表在《美國化學學會 ACS Nano 期刊:Bioengineered Bacteriophage-Like Nanoparticles as RNAi Therapeutics to Enhance Radiotherapy against Glioblastomas》,並獲選為期刊封面故事。
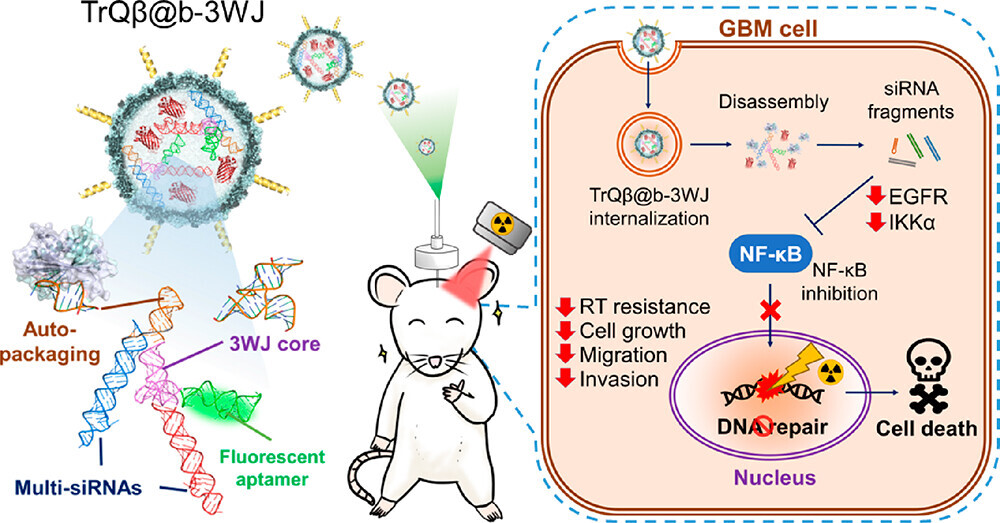
大腦內有「血腦屏障」保護,傳統藥物分子很難穿透。而膠質母細胞瘤又有很強大的基因修復能力。兩大因素造成腦癌治療效果極不理想。隨著生醫技術發展,將奈米粒子當成載具,攜帶藥物穿越血腦屏障,可望提高治療成效。
楊閎蔚教授表示,團隊以小鼠為實驗對象,將奈米 RNA 藥物,透過「對流增強輸送」方法,直接遞送至惡性腦瘤中,克服了血腦屏障。結果顯示,藥物降低腫瘤內 EGFR 和 IKKα 兩種基因的表現,從而抑制惡性腦瘤細胞 DNA 修復的轉錄因子 NF-κb,成功阻斷腫瘤細胞 DNA 修復。
團隊又對接受 RNA 奈米藥物後的惡性腦瘤小鼠照射低劑量的 X 射線,小鼠的中位存活時間超過 60 天。僅照射 X 射線的惡性腦瘤小鼠,中位存活天數只有 31 天。同時與使用臨床化療藥卡鉑結合 X 射線治療的惡性腦瘤小鼠的中位存活天數相比,也提升了 20% 效果且副作用更小。
傳統RNA奈米藥物做法繁複,要分別以人工合成 RNA、設計載體,再合而為一,過程耗時費力,成本高,而且穩定性不佳。
楊閎蔚教授團隊,以模組化 RNA 骨架設計的方式合成所需的 RNA 結構,能夠因應不同疾病治療需求快速修改。楊閎蔚教授解釋,模組化 RNA 骨架,就如同樂高基木,基木本身有許多接點,想設計成什麼模樣都可以。楊閎蔚教授團隊利用基因工程技術,開發在細胞自動生成所需的 RNA 並直接封裝在噬菌體內部,一步到位的做法,大幅提升 RNA 的穩定性與效率並降低成本。這也是研究成果獲選為封面故事的重要原因。
楊閎蔚教授說,針對模組化 RNA 骨架設計已建構了一個數位化平台,只需挑選好不同疾病特性標靶基因序列,就能直接計算出最穩定的 RNA 並成生序列,過程僅需幾分鐘。
此一跨校、跨領域團隊,整合成功大學、林口長庚醫院、中山大學。研究團隊成員包括,成大博士後研究員龎浩翰博士、博士後研究員李南熺、博士候選人許盈培。林口長庚醫院魏國珍醫師、陳品元醫師、博士後研究員黃瓊瑩博士。
龎浩翰博士表示,整個研究期間橫跨 4 年,最困難處在於模組化 RNA 骨架的設計,因為沒有現成的可以使用或改用,團隊必須自行開發與驗證,甚至連分析方法也要自行開發。從0到獲得國際期刊肯定,過程中遇到非常多的挫折,非常感謝團隊夥伴的相互扶持。楊閎蔚教授也再次感謝魏國珍醫師等跨校跨領域研究團隊,協助進行動物實驗,並在動物實驗上驗證了可能性。
《ACS Nano》由美國化學學會(American Chemical Society)發行,為奈米、奈米製造技術與奈米科學領域的頂尖期刊。
楊閎蔚教授 Yang, Hung Wei
https://www.scopus.com/authid/detail.uri?authorId=57201869935
維護單位: 新聞中心
更新日期: 2023-06-29

楊閎蔚教授研究團隊
基因工程RNA藥物由顱內注入腫瘤區,抑制癌細胞基

研究期間歷經許多挫折,終於取得美好成果並獲國際肯定

跨領域研究團隊成員相互扶持、努力下,研究成果登上國際頂尖期刊






